

流式细胞术(Flow Cytometry,简称FCM)是以流式细胞仪为检测手段的一项能快速、准确的对细胞或微粒的理化特性进行多参数定量分析和分选的技术。利用流式细胞术可以分析细胞的大小、颗粒度、细胞抗原表达情况、DNA含量等多种重要参数;使用具有分选功能的流式细胞仪,可以实现从大量细胞中分选特定感兴趣的细胞亚群,分选得到的细胞可应用于生命科学研究的多个领域。
流式细胞术技术特点
流式细胞仪工作原理
流式细胞仪
流式细胞仪(Flow Cytometer)是对细胞或微粒进行分析和分选的设备,集细胞与分子生物学、流体力学、激光技术、光电子技术、计算机技术、细胞荧光化学技术、抗体技术为一体的高科技仪器。
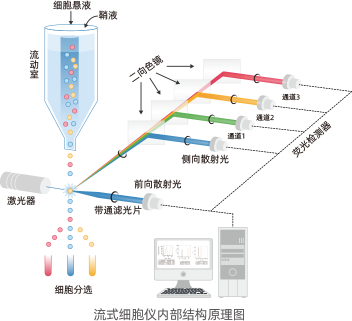
流式细胞仪内部结构:
光学系统:激光光源、光收集系统
液流系统:流动室、液流驱动系统
电子系统:光电转换器、数据处理系统
细胞分选系统:喷嘴、电偏转板、样品收集器
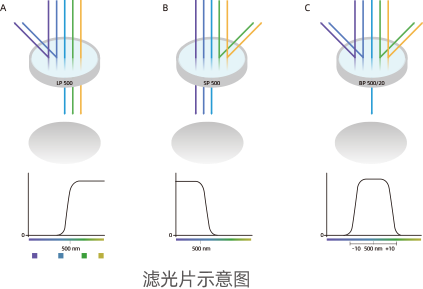
滤光片
滤光片为流式细胞仪光学系统的重要元件,使流式细胞仪能够根据波长区分不同发射光,从而实现对多个检测通道同时进行分析,滤光片主要分为三类,分别是长通、短通、带通滤光片。
滤光片分类:
长通滤光片(Long-pass filter, LP):只允许特定波长以上的光束通过
短通滤光片(Short-pass filter, SP):只允许特定波长以下的光束通过
带通滤光片(Band-pass filter, BP):只允许一定波长范围内的光束通过
流式细胞仪检测信号类型
单细胞液流进入流动室的激光照射区,细胞发出散射光信号和荧光信号,并分别由相应的探测器进行收集。
散射光信号
前向散射光(Forward Scatter, FSC),其信号方向与激光束平行,偏离度一般在1-6度范围内,又称小角度散射光,主要反映细胞相对大小;侧向散射光(Side Scatter,SSC),其信号方向和液流形成平面相垂直,又称90度散射光,其信号强度反映细胞内颗粒度和精细结构变化。

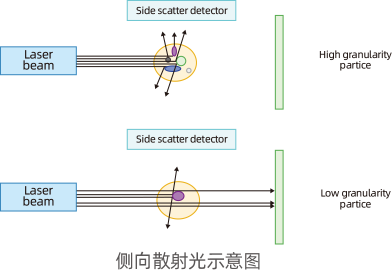
散射光信号用途
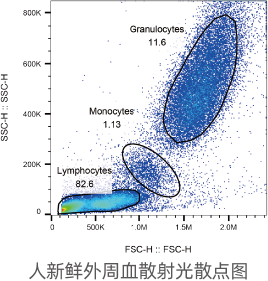
实验中经常利用FSC和SSC两个参数,区分不同细胞群体、去除碎片、死细胞及粘连细胞的干扰。
采用FSC反映细胞大小,SSC反映细胞颗粒度,区分不同细胞群体
荧光信号
自发荧光:天然存在的细胞组分如NADPH、核黄素、黄素辅酶分子可发出掩盖抗原特异性信号的荧光。
特异荧光:细胞与荧光染料偶联抗体或特定荧光染料结合后,该染料被相应激光激发所产生的特定波长的荧光。
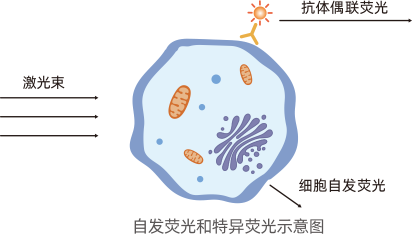
流式细胞术数据展示方式
流式细胞术可以分析大规模细胞样本,并形成单细胞的数据点。流式数据展示方式是多样化的,如常用的单参数直方图、双参数散点图等;随着流式实验参数和复杂性的增加,高维数据分析方法如tSNE、FlowSOM等得以使用,有助于研究者获得更多有价值的信息。

• 阴性、阳性细胞群比例
• 荧光强度的平均值或中位值(MFI)

• 更加直观表示细胞信息
• 可对特定细胞群、亚群进行分析

• 环线代表细胞密度相同的区域
• 直观体现细胞群的集中点

• 显示给定区域中事件相对数量
• 体现细胞群体的整体密度分布
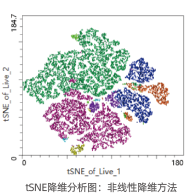
• 高维数据可视化为低维空间
• 测量高维空间中样本之间的相似性

• 一定程度还原数据中的高维结构
• 提升发现稀有细胞类群的可能
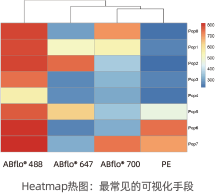
• 以颜色冷暖展示表达强度
• 丰富的色彩变化和生动饱满的信息表达