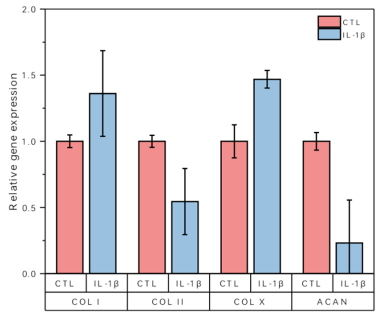
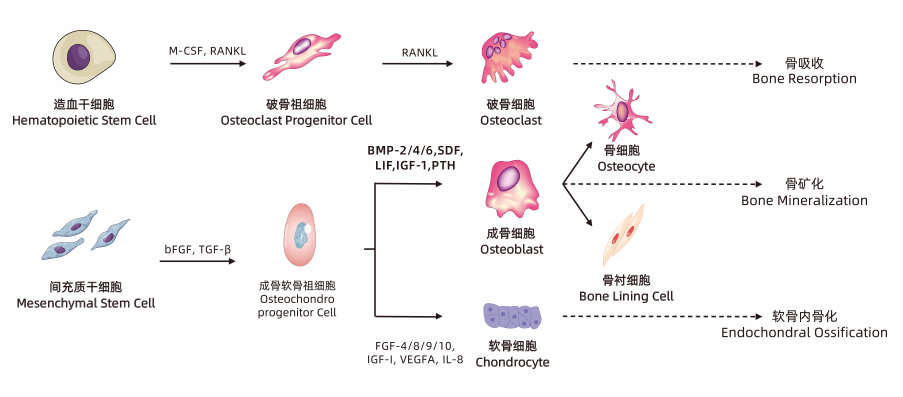
骨骼系统作为支持和保护身体内部器官的结构框架,主要由软骨和骨骼组成。骨骼生长和发育的过程中涉及到许多细胞类型,包括来源于骨髓间充质干细胞的成骨细胞和软骨细胞,以及来源于造血干细胞的破骨细胞,这些过程都离不开各类细胞因子的参与。
| 蛋白名称 | 物种 | Gene ID | 标签 | 表达系统 | 货号 |
|---|---|---|---|---|---|
| Recombinant Mouse TNFSF11/RANKL/CD254 Protein | Mouse | 21943 | N-His&N-hFC | HEK293 cells | RP02134 |
| Recombinant Mouse TNFSF11/RANKL/CD254 Protein (With Carrier) | Mouse | 21943 | N-His&N-hFC | HEK293 Cells | RP02134C |
| Recombinant Human TNFSF11/RANKL/CD254 Protein | Human | 8600 | N-HiS-hFC | HEK293 Cells | RP00183S |
| Recombinant Mouse CSF-1/M-CSF Protein | Mouse | 12977 | No-Tag | HEK293 cells | RP01216S |
| Recombinant Mouse CSF-1/M-CSF Protein (With Carrier) | Mouse | 12977 | NO-tag | HEK293 cells | RP01216SC |
| Recombinant Human CSF-1/M-CSF Protein | Human | 1435 | C-His | HEK293 cells | RP01221 |
| Recombinant Rat CSF-1/M-CSF Protein | Rat | 78965 | C-His | HEK293 cells | RP01847 |
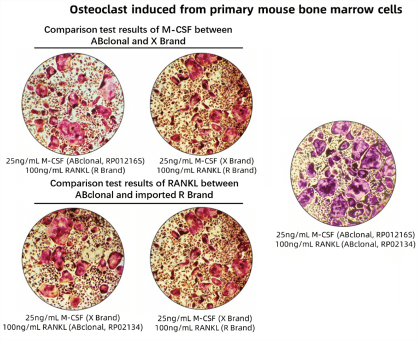
| TRAP 染色试剂盒 | / | / | 本产品仅用于科研。破骨细胞显示 | RPM0052K |
| 细胞孔板 | 孔面积(cm2) | 推荐测试细胞数范围 |
|---|---|---|
| 细胞96孔板 | 0.33 | 0.2-1 W |
| 细胞48孔板 | 0.84 | 0.5-2.5 W |
| 细胞24孔板 | 1.93 | 1-6 W |
| 细胞12孔板 | 3.85 | 1.5-9 W |
| 细胞6孔板 | 9.6 | 5-20 W |
| 10 cm2细胞培养皿 | 60.8 | 30-250 W |